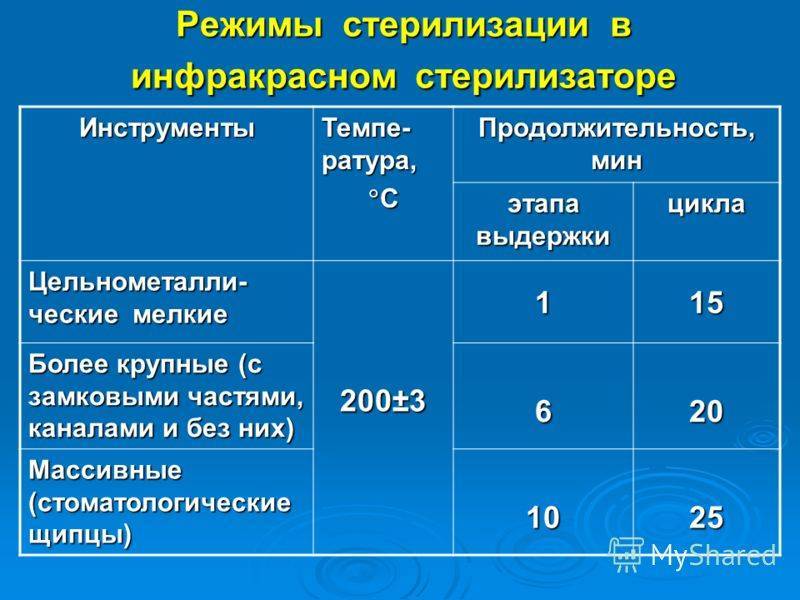
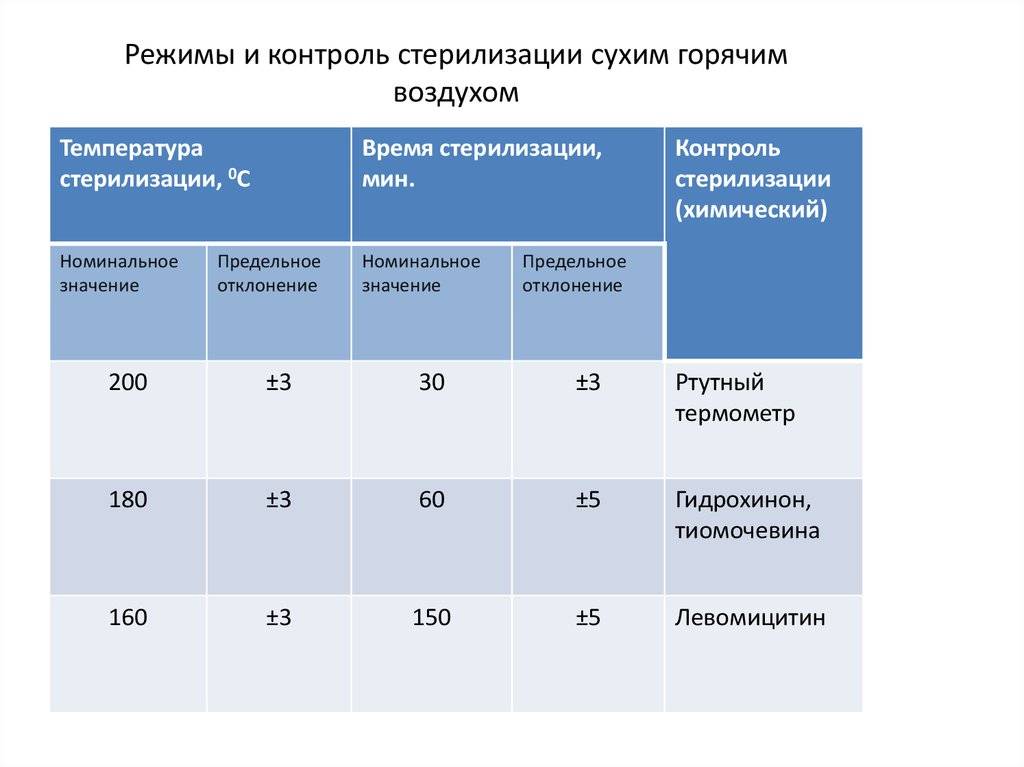
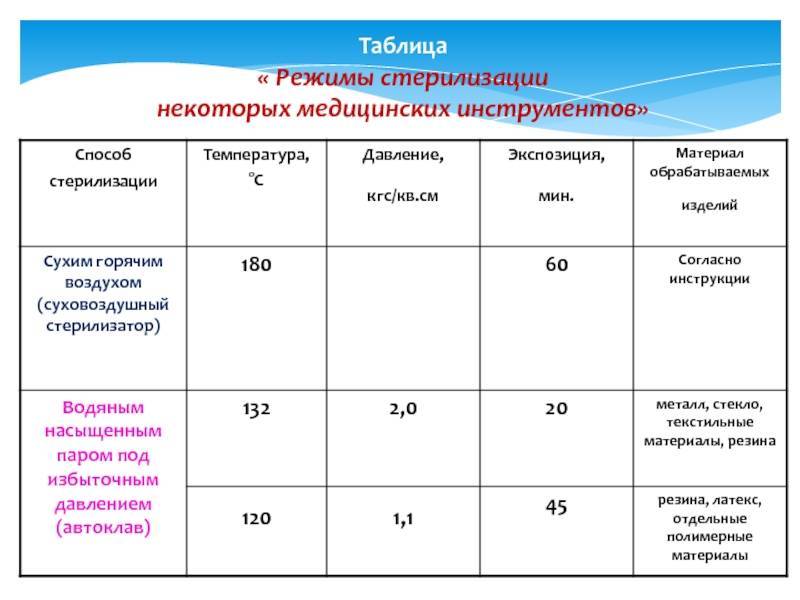
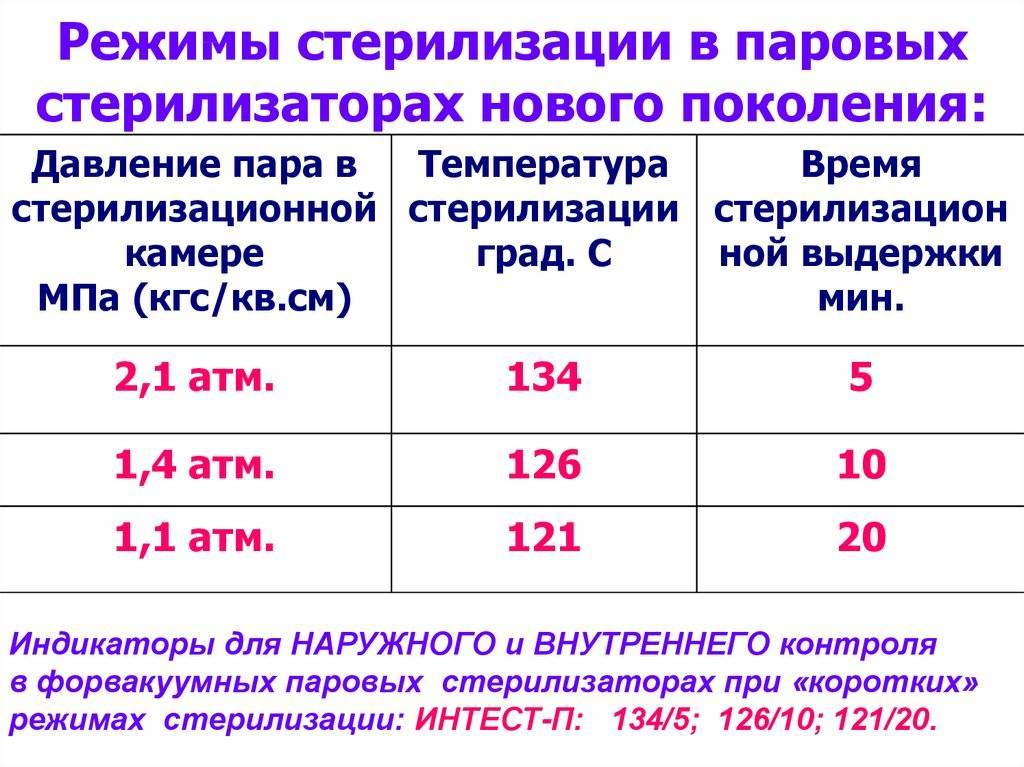
Гравитационные стерилизаторы (с удалением воздуха продувкой паром)
В России до 1989 г. паровая стерилизация изделий медицинского назначения проводилась в гравитационных стерилизаторах в соответствии с ОСТ 42-21-2-85.
В 1989 г. в соответствии с ГОСТ 19569-891 были введены пять новых (т. н. коротких) режимов паровой стерилизации ИМН.
По данному стандарту в стерилизаторах с объемом камеры 100 л и более удаление воздуха должно осуществляться только методом пульсирующей (форвакуумной) откачки. Требования стандарта не распространяются на стерилизаторы, выпущенные и находящиеся в эксплуатации до 1996 г. С 1996 г. в ЛПУ для стерилизации ИМН должны были вводиться в эксплуатацию только форвакуумные стерилизаторы.
Безопасный ресурс эксплуатации гравитационных стерилизаторов — 10 лет, соответственно, к 2006 г. все гравитационные паровые стерилизаторы с объемом стерилизационной камеры 100 л и более, выпущенные до 1996 г. и применяемые для стерилизации ИМН, должны быть заменены форвакуумными паровыми стерилизаторами.
По ГОСТ Р 13683-20022 гравитационные стерилизаторы предназначены для стерилизации изделий без пор и внутренних полостей. Такие стерилизаторы рекомендованы для стерилизации герметично закупоренных флаконов с растворами.
К сожалению, в российских медицинских учреждениях для стерилизации ИМН до сих пор в основном применяются старые стерилизаторы с гравитационным способом удаления воздуха: через продувочный клапан в нижней части стерилизатора удаляется воздух, более тяжелый по сравнению с паром, который поступает через клапан в верхней части камеры. Пар постепенно заполняет камеру, замещая воздух. К этому типу относятся отечественные стерилизаторы ВК-75, ГК-100, ГК-100-3, ГК-100-ЗМ, ГП-400, ГПС-560, ГПД-700, ЦСУ-1000-0.
Гравитационные стерилизаторы не соответствуют современным требованиям по таким параметрам, как обеспечение эффективности удаления воздуха, эффективность стерилизации, увлажненность изделий после стерилизации, отсутствие средств контроля и документирования процесса, а также запрограммированных циклов стерилизации.
Большим недостатком морально устаревших гравитационных стерилизаторов является отсутствие средств эффективной сушки изделий после стерилизационной выдержки. В таких стерилизаторах увлажненность хлопчатобумажных изделий после сушки при включенном конденсаторе или эжекторе3 составляет 3-5%, в то время как она не должна превышать 1%. Для влажных ИМН существуют риск повторной кантоминации и вероятность использования нестерильных изделий. В некоторых стерилизаторах, например ВК-75, ГК-100, совсем не предусмотрена сушка изделий после стерилизации. При замене физически изношенного (с выработанным ресурсом) и морально устаревшего оборудования в первую очередь необходимо заменять паровые стерилизаторы без средств послестерилизационной сушки.
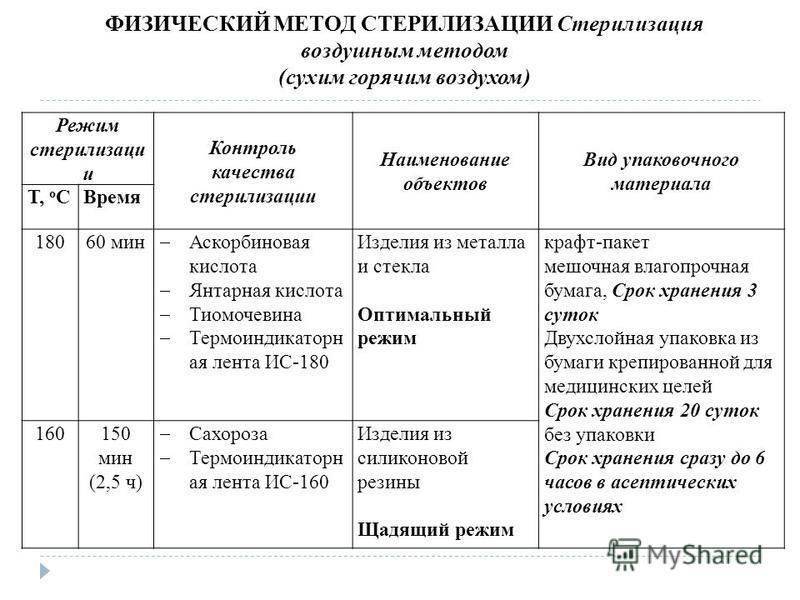
В гравитационных стерилизаторах за счет недостаточного удаления воздуха наблюдается очень медленный прогрев пористых изделий — до 25 мин от начала стерилизационной выдержки. Поэтому в таких стерилизаторах используют только «длинные» режимы стерилизации — «120+2°С, 45 мин», «132±2°С, 20 мин».
Заменить сразу все гравитационные паровые стерилизаторы на форвакуумные по всей территории России невозможно. Они заменяются по мере физического износа и появления финансовых средств у ЛПУ. Для обеспечения надежной стерилизации в гравитационных стерилизаторах необходимо:
- обеспечить эффективное удаление воздуха из стерилизационной камеры, не менее 10 мин осуществляя продувку паром в режиме «120+2°С, 45 мин», а при режиме «132±2°С, 20 мин» — длительность продувки увеличивается до 15 мин;
- проводить периодический контроль микробиологической эффективности стерилизации с помощью Тест-ИБ4;
- регулярно проводить периодический контроль удаления воздуха из камеры стерилизатора с помощью Тест-ИХ5; по стандарту ГОСТ Р ИСО 13683-2000 такой контроль дол жен проводиться не менее одного раза в неделю;
- ввести контроль увлажненности ИМН после стерилизации по методике ГОСТ Р 51935-2002.
Разработка прогрессивного способа обработки коллаген содержащего сырья
Разработан новый способ ферментации свиной шкурки куриным пепсином в рассоле с добавлением молочной кислоты.
Выполненные нами фундаментальные исследования возможности использования таких ферментных препаратов животного происхождения как сычужный порошок, говяжий и куриный пепсины, позволили оценить их про-теолитическую и коллагеназную активность, оптимум действия, условия инактивации. Результаты исследований представлены в табл. 3.2-1-3.2-2.
Как видно из таблицы 3.2-1, наибольшей протеолитической активностью обладает куриный пепсин, затем следует говяжий пепсин и сычужный порошок. Однако, необходимо отметить, что из исследуемых ферментных препаратов наибольшей коллагеназной активностью обладает куриный пепсин.
Для решения вопроса возможности использования ферментных препаратов и подбора технологических параметров изучались условия инактивации ферментных препаратов. Ферментные препараты прогревали до температур 50, 60, 70, 75, 80 С и выдерживали при каждой температуре в течение 15 минут, после чего определяли остаточную протеолитическую активность ферментов (табл. 3.2-2). Таблица 3.2-2 Остаточная активность ферментных препаратов после термической обработки Установлено, что при нагреве ферментных препаратов до 50С и выдержке при этой температуре в течение 15 минут инактивируется сычужный порошок, а при 70С — говяжий и куриный пепсин.
После определения протеолитической и коллагеназной активности исследуемых ферментных препаратов для дальнейшего изучения был выбран куриный пепсин с концентрацией 0,3%; 0,5; 0,7% к массе сырья.
С целью изучения влияния ферментного препарата на изменения физико-химических и структурно-механических качественных характеристик в модельных системах определяли активную кислотность, водосвязывающую способность, степень пенетрации. Результаты исследований представлены на рис. 3.2-1-3.2-3.
Полученные результаты дают основание сделать вывод, что введение в систему в процессе посола ферментного препарата повышает водосвязываю-щую способность и гидратацию белков, возможно иллюминируя Са++ и Mg++, связанные в виде хелатов с белками. Вероятно, происходит взаимодействие активных центров ферментного препарата с коллагеном шкурки. Это способствует разрыхлению структуры белков и увеличению иммобилизованной воды, что сопровождается улучшением структурно-механических характеристик.
Водосвагмвающая Степень пснетрации концентрация 0 0,3 0,5 0,7 ферментного концентрация ферментного препарата препарата
Анализ результатов микроструктурных исследований свидетельствует, что добавление ферментного препарата приводит к изменениям как в структуре мышечной, так и соединительной ткани. Глубина этих изменений находится в прямой зависимости от концентрации используемого препарата. Структура образцов шкурки после посола с куриным пепсином 0,5%-ной концентрацией, отличается от контрольного образца более существенными деструктур-ными изменениями мышечной и соединительной тканей (рис.3.2-3). После термической обработки опытные образцы характеризуются набуханием мышечных волокон и множественными деструктивными изменениями с образованием мелкозернистой белковой массы. В структуре волокнистого компонента соединительной ткани отмечены глубокие деструктивные изменения, характеризующиеся разрыхлением и разволокнением пучков коллагеновых волокон, частичным лизисом коллагеновых фибрилл и образованием глютина (рис. 3.2-4).
УРОВЕНЬ ОБЕСПЕЧЕНИЯ СТЕРИЛЬНОСТИ
Для методов, описанных ниже, в случае необходимости, указывают уровень обеспечения стерильности (УОС).
Уровень обеспечения стерильности процесса стерилизации – это степень гарантии, с которой процесс обеспечивает стерильность всех единиц продукции в серии. Для конкретного процесса уровень обеспечения стерильности определяется как вероятность наличия нестерильной единицы в серии. Например, УОС = 10−6 означает, что в подвергнутой стерилизации серии готового продукта объемом 106 единиц существует вероятность наличия не более одного жизнеспособного микроорганизма. Уровень обеспечения стерильности процесса стерилизации для конкретного продукта устанавливают в процессе валидации.
Этапы цикла обработки изделий медицинского назначения
Итак, изделия медицинского назначения (ИМН), если они в процессе эксплуатации соприкасаются с раневой поверхностью, контактируют с кровью или со слизистой оболочкой различных органов должны пройти 3 этапа обработки.
Дезинфекция изделий медицинского назначения
Сразу после использования все изделия медицинского назначения подвергают дезинфекции. Этот этап обработки призван сделать их безопасными для медицинского персонала и исключить распространение возбудителей в окружающей среде.
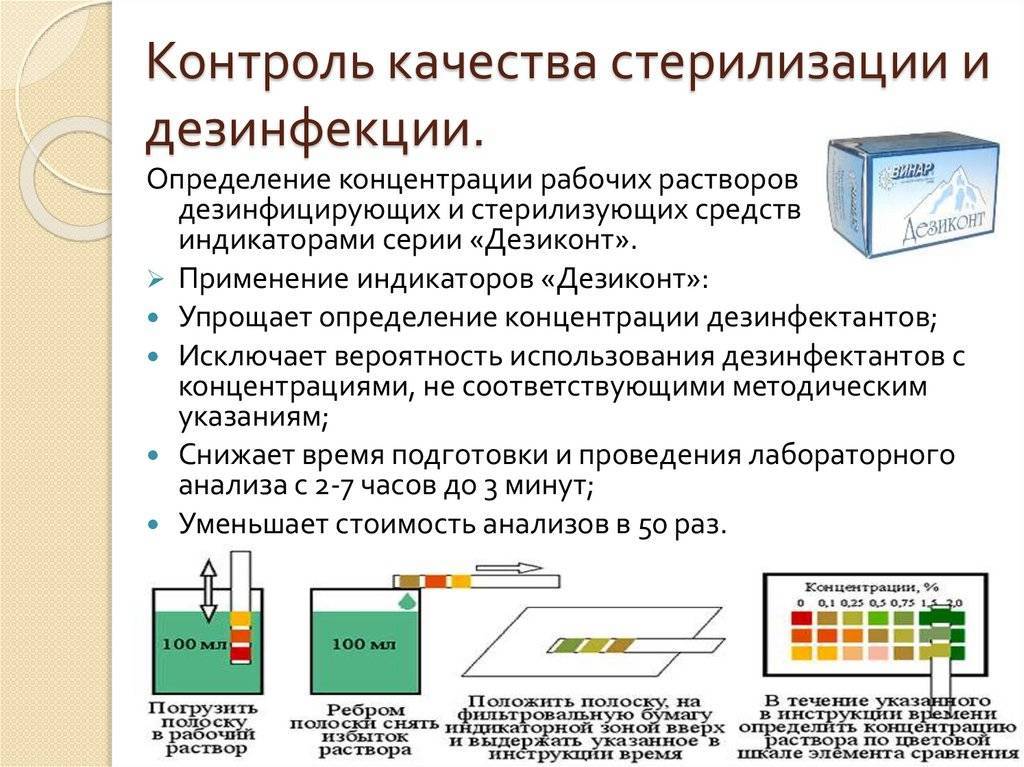
Для проведения дезинфекции изделия погружают в рабочий раствор дезинфекционного средства на время процедуры, установленное в нормативно-методическом документе по применению конкретного средства. После окончания процесса обеззараживания изделие тщательно отмывают от остатков дезинфекционного средства.
Предстерилизационная очистка
Предстерилизационная очистка (ПСО) – этап цикла по обработке ИМН, предусматривающий удаление с изделий белковых, жировых, механических загрязнений и остаточных количеств лекарственных препаратов. При выборе средств для дезинфекции и очистки имеет значение отсутствие у них фиксирующего действия. Так, например, альдегид-содержащие дезинфекционные средства обладают выраженным фиксирующим действием, в результате чего органические загрязнения прочно фиксируются на поверхности обрабатываемых изделий. А это в свою очередь может стать причиной неэффективной дезинфекции и очистки.
Современные композиционные дезинфекционные средства позволяют совместить при использовании раствора одного средства дезинфекцию и ПСО изделий. Для этого используют ферментные средства, обеспечивающие разложение белковых, углеводных и жировых загрязнений, имеющих в составе антимикробные компоненты.
Стерилизация изделий медицинского назначения – финишная прямая
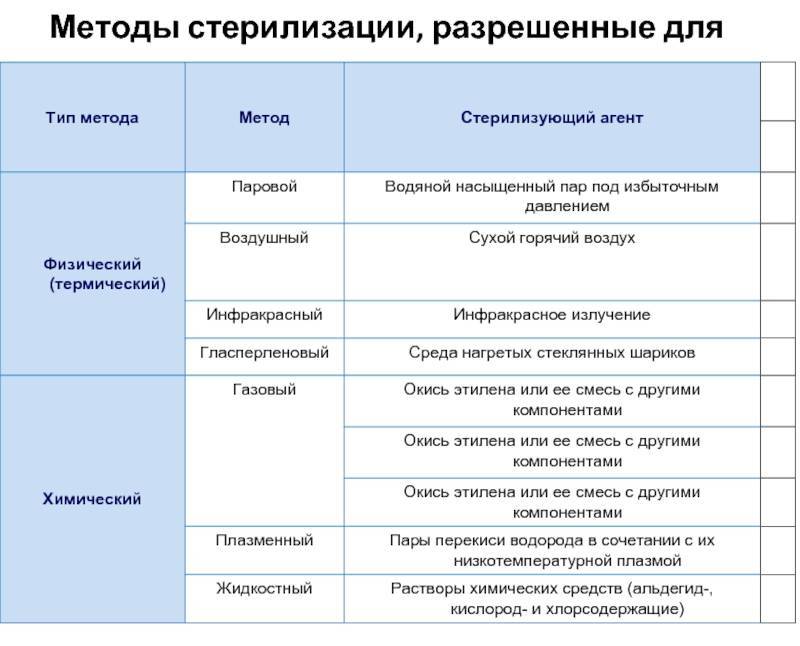
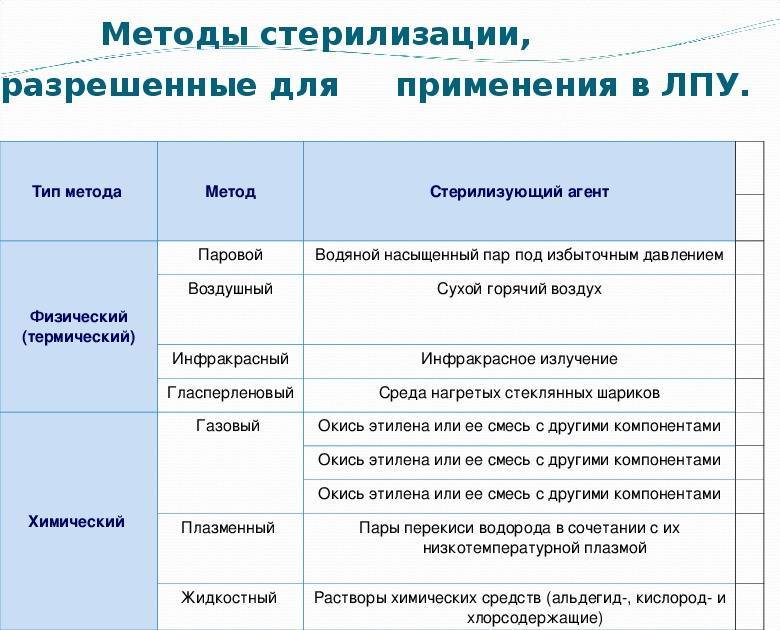
Стерилизация изделий медицинского назначения является последним этапом обработки. Для ее выполнения, скажем, в лечебно-профилактических учреждениях используются термические, химические методы и их комбинация. К термическим относят паровой, воздушный, инфракрасный, гласперленовый. А к химическим – газовый, плазменный, озоновый и растворами химических средств.
То, каким именно методом можно воспользоваться для стерилизации конкретных изделий, зависит от самого метода и его особенностей
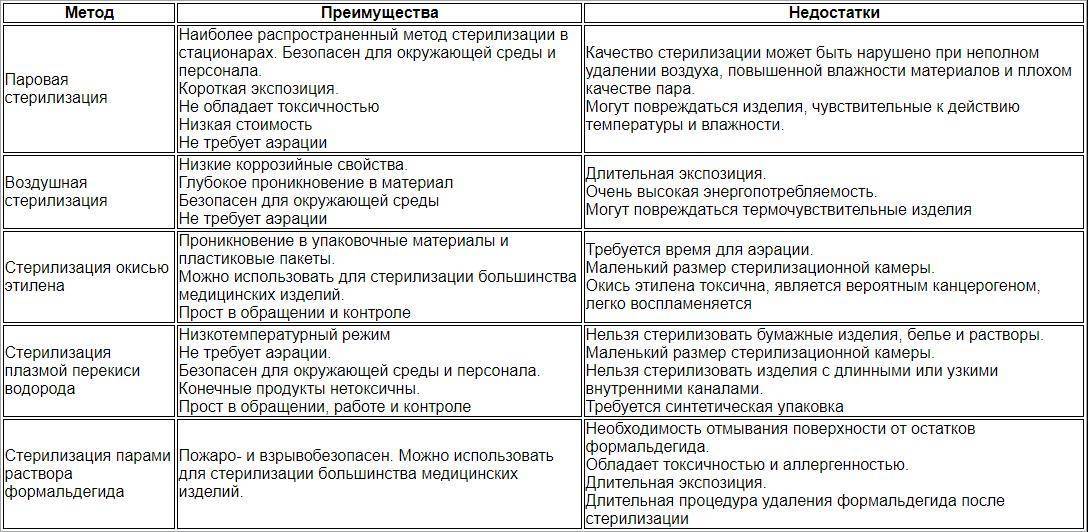
Специалисты считают, что в момент выбора важно учитывать все достоинства и недостатки разных методик, поскольку ни один из существующих методов стерилизации не является абсолютно идеальным.. Так, самым распространенным методом в лечебно-профилактических учреждениях признаны паровой и воздушный
Но какой бы из методов ни выбрал специалист, он должен будет учесть требования к средствам предстерилизационной очистки и стерилизации медицинских изделий, которые должны иметь:
Так, самым распространенным методом в лечебно-профилактических учреждениях признаны паровой и воздушный. Но какой бы из методов ни выбрал специалист, он должен будет учесть требования к средствам предстерилизационной очистки и стерилизации медицинских изделий, которые должны иметь:
- высокую активность за возможно короткое время;
- безопасность для персонала, пациентов, окружающей среды;
- хорошую совместимость с материалами изделий, выражающуюся в отсутствии повреждающего действия на материалы;
- возможность контроля процесса;
- простоту и удобство применения;
- приемлемую стоимость и доступность;
- высокую стабильность, способствующую приемлемому сроку хранения химического средства, быструю и полную его растворимость в воде;
- отсутствие раздражающего запаха.
Дезинфекция и стерилизация: разница есть!
Начнем с того, что под дезинфекцией понимается комплекс мероприятий, который направлен на уничтожение возбудителей инфекционных заболеваний и разрушение токсинов на объектах внешней среды. Это всего лишь один из видов обеззараживания, который предотвращает попадание токсинов и микробов на кожу или слизистые. Дезинфекция может и не уничтожить их полностью, но в любом случае уменьшит количество.
В качестве действующего вещества дезинфекции – дезинфектанта – используются химические дезинфицирующие средства. Например, такие, как формальдегид или гипохлорит натрия, растворы органических веществ, обладающих дезинфицирующими свойствами: хлоргексидин, четвертичные аммонийные соединения (ЧАСы), надуксусная кислота, полигуанидины (ПГМГ-ГХ).
Дезинфекция бывает профилактическая, которая проводится постоянно, независимо от эпидемической обстановки, и делится в свою очередь на плановую, внеплановую, текущую и итоговую профилактику. Именно к дезинфекции относят мытье рук и окружающих предметов с использованием моющих средств, содержащих бактерицидные добавки.
Специалисты утверждают, что уничтожение инфекционного начала во внешней среде еще не обеспечивает устранение основных источников инфекции. Поэтому дезинфекция важна только в общем комплексе противоэпидемических мероприятий.
К слову, медицинские работники даже утилизировать некоторые инструменты одноразового использования (шприцы, иглы для инъекций и т.д.) не могут без предварительной обязательной дезинфекции. И, как вы уже понимаете, она нужна не только в медицине, но и в обычной жизни. Например, обеззараживание помещения или инструмента для маникюра. После этой процедуры количество вредных микроорганизмов сокращается на 70-80%.
Стерилизация же обеспечивает полное освобождение какого-либо предмета или материала от всех видов микроорганизмов (включая бактерии и их споры, грибы, вирусы), либо их уничтожение. То есть абсолютное уничтожение всего живого в любом его проявлении и всех продуктов его жизнедеятельности. Осуществляется термическим, химическим, радиационным, фильтрационным методами.
Процесс стерилизации состоит из трех этапов и включает в себя: дезинфекцию, предстерилизационную обработку и собственно стерилизацию.